НПО "Альтернатива" - 7.7. Основное оборудование и растворы для технохимического контроля производства
Опубликовано: 02.09.2018

7.7. Основное оборудование и растворы для технохимического контроля производства
Средства измерений и их поверка
Лаборатория хлебозавода должна иметь оборудование и материалы, обеспечивающие выполнение всех анализов, выполняемых как сплошным, так и выборочным способом. В число приборов, необходимых для этой цели, входят технические весы грузоподъемностью от 200 г до 5 кг, аналитические весы грузоподъемностью до 200 г, электрический сушильный шкаф СЭШ, прибор ВЧМ, термостат, лабораторная печь, прибор Журавлева для определения пористости хлеба, биологический микроскоп,
"Сланцы": экономя сейчас, не прогадать в будущем
прецизионный или лабораторный рефрактометр, центрифуга, ареометры, психрометры и термометры. Желательно иметь также автоматизированный пенетрометр АП-4 и универсальный рефрактометр РЛУ или ИРФ-22.
Значительная часть средств измерений подлежит обязательной поверке в органах государственной метрологической службы согласно СТБ.
Продается дом в с. Алабушево рядом с г. Зелено...
Приборы Журавлева для контроля пористости хлеба поверяются 1 раз в 24 месяца, измеритель деформации клейковины — ИДК— 1 разе 12 месяцев, весы лабораторные всех классов точности — 1 раз в 12 месяцев, ареометры для спирта — 1 раз в 24 месяца, сахарометры — 1 раз в 24 месяца, сахарометры общего назначения — 1 раз в 48 месяцев, сахарометры для молока — 1 раз в 24 месяца, спиртометры металлические — 1 раз в 12 месяцев, психрометры (влагомеры) — 1 раз в 12 месяцев, термометры стеклянные электроконтактные — 1 раз в 24 месяца.
Сроки поверки остальных приборов согласовываются с местными органами стандартизации.
Количество бюксов для шкафов СЭШ должно равняться 10, а для других шкафов — числу бюксов, обычно загружаемых в шкаф. Верхнюю полку электрошкафа делят на прямоугольные участки, в центр каждого из них помешают бюксы с навесками продуктов. В шкафах марки СЭШ загружают бюксами все имеющиеся гнезда. Высушивание, охлаждение и взвешивание навесок муки и хлеба, а также подсчет результатов анализа производят, строго придерживаясь стандартной методики. Расхождения между результатами параллельных определений на отдельных участках шкафа должны быть не более 0,25% для муки и 1% для хлеба. Желательно, чтобы отклонения были минимальными. Участки, на которых получены большие отклонения при определении влажности продуктов, в дальнейшем не используют. Проверка объема пробника Журавлева необходима для составления таблицы, по которой вычисляют пористость хлеба. Определяя объем пробника, замеряют внутренний диаметр его цилиндрической части dи расстояние hв миллиметрах от вертикальной стенки станка до ножа, вставленного в прорезь прибора. Для измерений пользуются штангенциркулем и линейкой с миллиметровыми делениями.
Объем пробника вычисляют по формуле
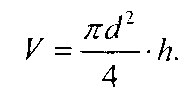
Таблицу для подсчета пористости хлеба составляют следующим образом: поочередно задаются значениями пористости с разрывом на 1%, начиная с минимального, подставляют эти значения в формулу для подсчета пористости и находят из нее соответствующую массу хлебного мякиша в объеме трех-четырех выемок. Формула, алгебраически преобразованная для определения массы мякиша, имеет следующий вид:
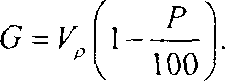
Приготовление рабочих растворов
При приготовлении рабочих растворов необходимо соблюдать следующие требования. При приготовлении титрованных растворов:
кислоты соляной (НС1), растворы должны быть следующих молярных концентраций:1 моль/дм3 (1 н.);
0,5 моль/дм3 (0,5 н.);
0,1 моль/дм3 (0,1 н.);
натрия гидроокиси (NaOH), растворы — молярных концентраций:1 моль/дм3 (0,5 н.);
0,5 моль/дм3 (0,5 н.);
0,1 моль/дм3 (0,1 н.).
Титрованные растворы предназначены для титрометрических определений и содержат в определенном объеме точно известные количества активного вещества.
За основу расчетов при приготовлении и проверке титрованных растворов взято понятие «молярная масса эквивалента». Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента.
Точную молярную концентрацию (с, моль/дм3) с коэффициентом поправки вычисляют по формуле
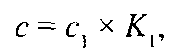
где с1 — заданная молярная концентрация вещества в растворе, моль/дм3; К1 — коэффициент поправки.
Точную молярную концентрацию (с, моль/дм3) без коэффициента поправки вычисляют по формуле
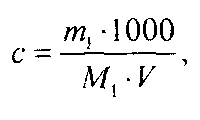
где m1 — масса навески установочного вещества, г; М1— молярная масса эквивалента установочного вещества, г/моль; V — объем анализируемого раствора, израсходованный на титрование, см3.
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой.
Коэффициент поправки (К) определяют по установочным веществам или их растворам.
При применении установочного вещества коэффициент поправки вычисляют по формуле
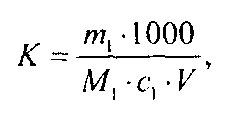
где m1 — масса навески установочного вещества, г; М1 — молярная масса эквивалента установочного вещества, г/моль; с1 — заданная молярная концентрация вещества в растворе, моль/дм3; V — объем анализируемого раствора, израсходованный на титрование, см3.
При применении раствора установочного вещества (заданная молярная концентрация обоих растворов одинаковая), коэффициент поправки вычисляют по формуле
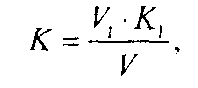
где V1— объем раствора установочного вещества, взятый или израсходованный на титрование, см3; К1 — коэффициент поправки раствора установочного вещества; V — объем анализируемого раствора, взятый или израсходованный на титрование, см3.
Приготовление раствора. 250 г гидроокиси натрия растворяют в фарфоровом или фторопластовом стакане в 250 см3 воды. После охлаждения раствора до комнатной температуры его переносят в стеклянный или полиэтиленовый сосуд, закрывают резиновой или полиэтиленовой пробкой и в течение 2...3 недель выдерживают до полного осаждения углекислого натрия, не растворимого в растворе гидроокиси натрия указанной концентрации.
В отстоявшемся прозрачном концентрированном растворе устанавливают массовую долю концентрации гидроокиси натрия титрованием, при этом 1 см3 раствора, отобранного пипеткой, вместимостью 1 см3, доводят водой до 40 см3 и титруют из бюретки вместимостью 50 см3 раствором серной или соляной кислоты молярной концентрации 1 моль/дм3.
1 см3 раствора серной или соляной кислоты молярной концентрации соответствует 0,04 г гидроокиси натрия.
Коэффициент поправки определяют по серной или соляной кислоте. 30...40 см3 раствора кислоты (0,1 моль/см3), отмеренных из бюретки, помещают в коническую колбу, добавляют 3...4 капли раствора, смешанного с индикатором и титруют из бюретки раствором гидроокиси натрия до перехода красно-фиолетовой окраски раствора в зеленую.
Приготовление раствора марганцовокислого калия молярной концентрации (КМnO4). 3,25 г марганцовокислого калия растворяют в воде, доводят объем раствора до 1 дм3 и выдерживают в течение 20 сут. Затем раствор фильтруют через стеклянную воронку.
Допускается более быстрый способ приготовления раствора. 3,25 г марганцовокислого калия растворяют в 900 см3 воды в колбе вместимостью 1 дм3. Раствор нагревают приблизительно до 80°С, накрывают колбу, выдерживают при этой температуре в течение 2 ч, а затем выдерживают в течение 1 суток при комнатной температуре, после чего раствор фильтруют через стеклянную воронку.
Раствор хранят длительное время в склянке из темного стекла, избегая соприкосновения раствора с резиновыми трубками или пробками; при титровании пользуются бюретками со стеклянными кранами.
Определение коэффициента поправки по щавелевокислому натрию(Na2C204). 0,1500...0,2500 г щавелевокислого натрия помещают в коническую колбу вместимостью 250 см3, растворяют в 50 см3 воды, прибавляют 8 см3 серной кислоты, нагревают до 70...80°С, титруют из бюретки раствором марганцовокислого калия. При этом титрование проводят сначала очень медленно, не прибавляя последующей капли, пока предыдущая полностью не обесцветится. В конце титрования титруют быстрее до появления не исчезающей в течение 1 мин розовой окраски раствора.
Температура раствора в конце титрования должна быть не менее 60°С.
При необходимости в результате определения вносят поправку, устанавливаемую контрольным опытом.
Если К > 1,0, то разбавив раствор едкого натра водой, можно сделать его точно де- цинормальным.
Для этого на каждый литр приготовленного раствора нужно добавить столько миллилитров воды, сколько тысячных долей в поправочном коэффициенте после запятой. Например, если К = 1,238, то на каждый литр раствора следует добавить 238 мл дистиллированной воды и тщательно перемешивать его. При этом нужно очень тщательно отмерять раствор щелочи и объем добавляемой воды. Следует пользоваться для этого мерными колбами и пипетками. Разбавив раствор, необходимо убедиться (путем повторного титрования раствора щавелевой кислоты), что эта операция выполнена правильно. Нормальность раствора едкого натра значительно изменяется, если в него попадает воздух, содержащий пары воды, и углекислый газ; вследствие этого во всех случаях необходимо хранить приготовленный раствор в условиях, исключающих изменение его нормальности, и проверять периодически поправочный коэффициент.
Приготовление децинормального раствора кислоты (НСl или H2S04). Титрованный децинормальный раствор кислот (соляной или серной) можно приготовить из фикса- нала, перенося количественно содержимое одной ампулы в мерную колбу емкостью 1 л и добавив дистиллированную воду до метки. Ампулу с фиксаналом предварительно тщательно ополаскивают снаружи дистиллированной водой, в колбу вставляют воронку, в которую вкладывают стеклянный боек острием вверх. Опуская ампулу, ударяют вдавленной частью ее по острию бойка, другим бойком пробивают вдавленную сбоку часть ампулы, наблюдая, чтобы все содержимое фиксанала перешло в колбу. При помощи промывалки несколько раз тщательно промывают ампулу внутри и снаружи, давая стекать воде в колбу, затем промывают воронку с бойком, доливают в колбу воду до метки, закрывают пробкой и хорошо перемешивают. Если соответствующих фиксаналов нет, то измеряют ареометром плотность крепкого раствора химически чистой кислоты, имеющейся в лаборатории, находят по таблице процентную концентрацию раствора (в объемных процентах), а затем вычисляют, какой объем крепкой кислоты нужно взять, чтобы приготовить 1 л 0,1 н. раствора, пользуясь формулой
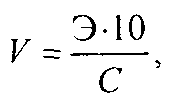
где Э — грамм-эквивалент кислоты; С — содержание кислоты в 100 мл крепкого раствора, г.
Чтобы получить раствор кислоты несколько крепче 0,1 н., отмеривают (маленьким цилиндром) концентрированной кислоты немного больше вычисленного количества и переносят ее без потерь в мерную колбу емкостью 1 л, доливают до метки воду и перемешивают. Определить титр приготовленного раствора кислоты можно по раствору щелочи известной концентрации, или по буре, что является более точным, но более сложным способом. В первом случае 25...20 см5 раствора NaOHотмеривают пипеткой в коническую колбу, прибавляют 1...2 капли раствора метилоранжа и титруют приготовленным раствором кислоты до перехода желтой окраски в слабо-розовую.
Поправочный коэффициент к раствору (К) вычисляют по формуле
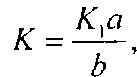
где K1— поправочный коэффициент к раствору щелочи; а — количество раствора щелочи, см3; b— количество раствора кислоты, см3.
Аналогичным способом из фиксанала можно приготовить раствор едкого натра (NaOH).
Приготовление процентных растворов. Растворы различных веществ с определенной процентной концентрацией применяют на производстве и в лабораторной практике.
Концентрацию вещества в растворе чаще всего выражают в весовых процентах, показывающих, сколько граммов вещества содержится в 100 г раствора (или сколько килограммов вещества в 100 кг раствора). Объемные проценты указывают, сколько граммов вещества содержится в 100 см3 раствора или сколько килограммов вещества в 100 дм3 раствора.
Плотность растворов выше, чем плотность воды, поэтому для одного и того же раствора объемные проценты всегда выражаются большим числом, чем весовые. Чтобы вычислить концентрацию вещества в объемных процентах, нужно весовые проценты умножить на плотность раствора.